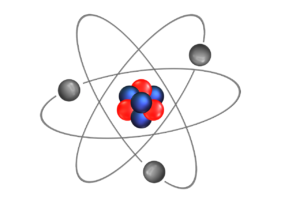
Czy kiedykolwiek zastanawiałeś się, co tak naprawdę kryje się w budowie materii? Atomy, będące najmniejszymi jednostkami, z których składają się wszystkie substancje, odgrywają kluczową rolę w chemii i są fundamentem naszego świata. Każdy atom, złożony z jądra oraz krążących wokół niego elektronów, decyduje o właściwościach chemicznych pierwiastków i ich związków. Zrozumienie tej podstawowej struktury oraz różnic między atomami różnych pierwiastków otwiera drzwi do fascynującego świata chemii, w którym wszelkie interakcje prowadzą do powstawania złożonych cząsteczek. Przygotuj się na odkrycie tajemnic budowy atomu i jego wpływu na naszą rzeczywistość!
Co to jest atom i dlaczego jest ważny?
Atom to najmniejsza jednostka strukturalna materii, z której składane są wszystkie substancje. Bez względu na to, czy mówimy o gazach, cieczy czy ciałach stałych, każdy materiał jest zbudowany z atomów. Kluczowe dla zrozumienia atomu jest jego wnętrze, które składa się z dwóch głównych elementów: jądra atomowego oraz elektronów krążących wokół niego.
Jądro atomowe, złożone z protonów i neutronów, jest centralną częścią atomu, odpowiedzialną za jego masę i większość jego właściwości chemicznych. Protony mają ładunek dodatni, natomiast neutrony są neutralne. Liczba protonów w jądrze decyduje o tym, do jakiego pierwiastka chemicznego należy dany atom – na przykład wodór ma jeden proton, podczas gdy węgiel ma ich sześć.
Elektrony, które są znacznie lżejsze od protonów i neutronów, poruszają się wokół jądra na określonych orbitach, utworząc powłokę elektronową. Ta struktura elektronowa jest kluczowa dla zrozumienia właściwości chemicznych atomów, ponieważ to właśnie rozmieszczenie elektronów decyduje o reaktywności chemicznej i możliwościach tworzenia związków z innymi atomami.
| Element | Rodzaj | Ładunek |
|---|---|---|
| Proton | Część jądra | Dodatni |
| Neutron | Część jądra | Neutralny |
| Elektron | Powłoka elektronowa | Ujemny |
Znajomość budowy atomu jest niezbędna w wielu dziedzinach nauki, w tym w chemii, fizyce, biologii czy nawet medycynie. Zrozumienie, jak atomy się łączą i tworzą różne związki chemiczne, a także jakie mają właściwości, jest fundamentem dla dalszego zgłębiania wiedzy o materii i jej zachowaniu.
Jakie są podstawowe składniki atomu?
Atom jest podstawową jednostką materii, zbudowaną z kilku kluczowych składników. Na jego strukturę składa się jądro atomowe, które jest centralnym punktem, wokół którego poruszają się inne cząsteczki. Jądro atomowe zawiera dwa rodzaje cząstek: protony i neutrony.
Protony, które są naładowane dodatnio, determinują ładunek atomowy oraz jego właściwości chemiczne. Ich liczba w jądrze nazywana jest liczbą atomową i określa, do jakiego pierwiastka należy dany atom. Na przykład, atom helu ma dwa protony, co klasyfikuje go jako pierwiastek helu.
Neutrony, z drugiej strony, są cząstkami obojętnymi, co oznacza, że nie mają ładunku elektrycznego. Ich obecność w jądrze wpływa na stabilność atomu oraz może prowadzić do powstawania izotopów, które różnią się liczbą neutronów, ale mają tę samą liczbę protonów.
Wokół jądra krążą elektronów, które mają ładunek ujemny. Elektrony poruszają się w określonych orbitach, tworząc powłokę elektronową. Liczba elektronów jest zazwyczaj równa liczbie protonów, co sprawia, że atom jest elektrycznie neutralny. W szczególnych przypadkach, gdy atom zyskuje lub traci jeden lub więcej elektronów, powstają jony, które mają ładunek elektryczny.
Podsumowując, podstawowe składniki atomu – protony, neutrony i elektrony – współpracują ze sobą, tworząc złożoną strukturę, która jest fundamentem dla całej materii we wszechświecie.
Jakie są różnice między atomami różnych pierwiastków?
Różnice między atomami różnych pierwiastków są podstawą chemii i wynikają przede wszystkim z liczby protonów, które znajdują się w jądrach atomowych. Liczba ta nazywana jest liczbą atomową i to właśnie ona definiuje dany pierwiastek. Na przykład, atomy węgla mają sześć protonów, co daje im liczbę atomową 6, podczas gdy atomy tlenu mają ich osiem, co odpowiada liczbie atomowej 8.
Właściwości chemiczne pierwiastków, takie jak reaktywność, struktura chemiczna czy forma występowania, są ściśle związane z ich liczbą atomową. Im więcej protonów w jądrze, tym bardziej skomplikowana staje się struktura elektronowa atomu, co wpływa na jego zdolność do tworzenia połączeń z innymi atomami. Pierwiastki z podobnymi liczbami atomowymi mogą wykazywać podobne właściwości chemiczne, co jest podstawą klasyfikacji pierwiastków w układzie okresowym.
Dodatkowo, każdy pierwiastek może mieć różne izotopy, które różnią się liczbą neutronów, ale nie protonów. Na przykład, węgiel ma kilka izotopów, w tym węgiel-12 i węgiel-14, które różnią się liczbą neutronów, a tym samym mają różne masy atomowe. Izotopy danego pierwiastka mogą mieć różne właściwości fizyczne, a niektóre z nich są radioaktywne, co dodatkowo wpływa na ich zastosowanie w nauce i technologii.
- Liczenie protonów: Liczba protonów ustala, jaki to pierwiastek.
- Izotopy: Różne neutrony w atomie tego samego pierwiastka wpływają na jego właściwości.
- Właściwości chemiczne: Zmiany w liczbie protonów i neutronów wpływają na reakcje chemiczne danego pierwiastka.
Jakie są podstawowe pojęcia związane z budową atomu?
Podstawowe pojęcia związane z budową atomu odgrywają kluczową rolę w chemii, ponieważ pozwalają zrozumieć, jak materiały są zorganizowane na poziomie subatomowym. Do najważniejszych terminów należą:
- Liczba atomowa to liczba protonów w jądrze atomowym danego pierwiastka. Określa ona również pozycję pierwiastka w układzie okresowym oraz jego właściwości chemiczne. Na przykład, wodór ma liczbę atomową 1, co oznacza, że zawiera jeden proton.
- Liczba masowa to suma liczby protonów i neutronów w jądrze atomowym. Liczba masowa pozwala zrozumieć masę atomową danego pierwiastka, co z kolei jest istotne przy przeprowadzaniu obliczeń dotyczących reakcji chemicznych.
- Izotopy to różne odmiany tego samego pierwiastka, które mają tę samą liczbę protonów, ale różnią się liczbą neutronów. Dzięki tym różnicom, izotopy mogą mieć różne właściwości, na przykład stabilność lub radioaktywność. Najbardziej znanym przykładem jest węgiel, który występuje jako węgiel-12 (stabilny) oraz węgiel-14 (radioaktywny).
- Konfiguracja elektronowa to rozmieszczenie elektronów wokół jądra atomowego. Określa, jak elektrownie są rozmieszczone w powłokach, co wpływa na właściwości chemiczne pierwiastka oraz jego reaktywność. Na przykład, pierwiastki z pełnymi powłokami elektronowymi są zazwyczaj mniej reaktywne, podczas gdy te z niesparowanymi elektronami są bardziej skłonne do uczestniczenia w reakcjach chemicznych.
Rozumienie tych terminów jest fundamentem, na którym opiera się dalsza nauka chemii i analizowanie reakcji chemicznych oraz interakcji między różnymi pierwiastkami. Każde z tych pojęć dostarcza niezbędnych informacji, które pozwalają lepiej zrozumieć, jak funkcjonuje materia w naszym świecie.
Jak atomy łączą się w cząsteczki?
Atomy łączą się w cząsteczki poprzez różne rodzaje wiązań chemicznych, które wpływają na ich właściwości i zachowanie. Najważniejsze typy wiązań to wiązania kowalencyjne, jonowe i metaliczne, które różnią się mechanizmem powstawania oraz siłą oddziaływania.
Wiązania kowalencyjne powstają, gdy dwa atomy dzielą się jedną lub więcej par elektronów. Ten typ wiązania jest szczególnie charakterystyczny dla związków organicznych, takich jak woda (H₂O) czy dwutlenek węgla (CO₂). Dzieląc elektrony, atomy osiągają stabilniejszą konfigurację elektronową, co prowadzi do powstania cząsteczek o unikalnych właściwościach chemicznych.
Wiązania jonowe mają miejsce, gdy jeden atom przekazuje elektron innemu, co prowadzi do powstania jonów o przeciwnych ładunkach. Te jony przyciągają się nawzajem, tworząc stabilne związki, takie jak chlorek sodu (NaCl). Wiązania jonowe są zazwyczaj silniejsze niż kowalencyjne, co czyni je kluczowymi w tworzeniu soli i innych związków o dużej twardości.
Wiązania metaliczne, z kolei, zachodzą w metalach, gdzie atomy dzielą swoje „luźne” elektrony w ramach tzw. „chmury elektronowej”. To delokalizowanie elektronów pozwala na doskonałe przewodnictwo elektryczne i cieplne oraz giętkość metali. Przykładami materiałów z wiązaniami metalicznymi są miedź i żelazo.
| Typ wiązania | Charakterystyka | Przykłady |
|---|---|---|
| Wiązanie kowalencyjne | Dzielone pary elektronów | Woda (H₂O), Dwutlenek węgla (CO₂) |
| Wiązanie jonowe | Przekazywanie elektronów między atomami | Chlorek sodu (NaCl) |
| Wiązanie metaliczne | Delokalizacja elektronów w metalu | Miedź, Żelazo |
Różnice w tych typach wiązań mają ogromny wpływ na właściwości materiałów, a zrozumienie tych procesów pozwala lepiej poznać świat chemii i stosować tę wiedzę w różnych dziedzinach, takich jak przemysł czy medycyna.